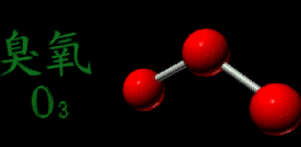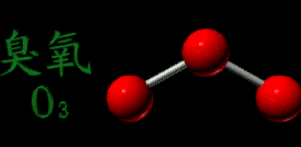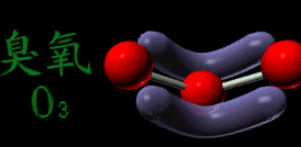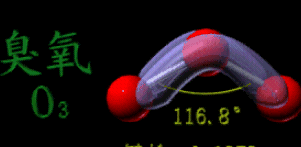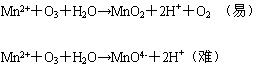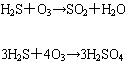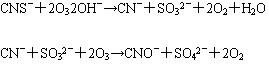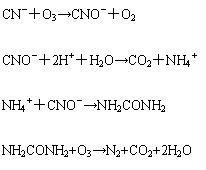臭氧的性質
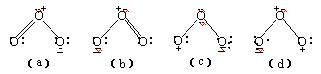
一、 臭氧的物理性質 臭氧是一種具有刺激性特殊氣味的不穩定氣體,分子結構如圖所示。它可在地球同溫層內光化學合成,但是在地平面上僅以極低濃度存在。
共振雜化分子的四種典型形
一種簡化的分子軌道圖
1.1 一般物理性質 在常溫下,臭氧為藍色氣體,不過在常溫下,藍色并不明顯,除非是相當厚的氣體。臭氧的主要物理性質列于表 1-1, 液體密度和蒸汽壓列于表 1-2 。 1-1 純臭氧的物理性質
①1dyn=10 -3 N/m;1atm=101.325Pa;1cal=4.18J 。 表 1-2 臭氧的液體密度和蒸氣壓
1.2 臭氧的溶解度 臭氧略溶于水,標準壓力和溫度下( STP ),其溶解度比氧大 13 倍(見表 1-3 ),比空氣大 25 倍。 表 1-3 臭氧在水中的溶解度(氣體分壓為 10 5 Pa ) /(ml/L)
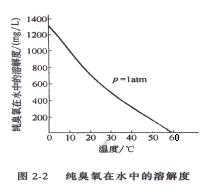
將臭氧通入蒸餾水中,可以測出不同溫度、不同壓力下臭氧在水中的溶解度。圖 2-2 是在壓力為 1atm 時,純臭氧在水中的溶解度和溫度的關系曲線。從圖2-2 知,當溫度為 0℃ 時,純臭氧在水中的溶解度可達 2.858×10 -2 mol/L(1372mg/L). 臭氧和其他氣體一樣,在水中的溶解度符合亨利定律,即在一定溫度下,任何氣體溶解于已知液體中的質量,將與該氣體作用在液體上的分壓成正比,而亨利常數的大小只是溫度的函數,與濃度無關。 C=K H P (1-1) 式中 C -臭氧在水中的溶解度, mg/L ; P -臭氧化空氣中臭氧的分壓, kPa ; K H -亨利常數, mg/ ( L·kPa )。 從式( 1-1 )知,由于實際生產中采用的多是臭氧化空氣,其臭氧的分壓很小,故臭氧的溶解度遠遠小于表 1-3 中的數據。例如,用空氣為原料的臭氧發生器生產的臭氧化空氣,臭氧只占 0.6 %~ 1.2 %(體積)。根據氣態方程及道爾頓分壓定律知,臭氧的分壓也只有臭氧化空氣壓力的 0.6 %~ 1.2 %。因此,當水溫為 25℃ 時,將這種臭氧化空氣加入水中,臭氧的溶解度只有( 0.625 ~ 1.458 ) ×10 -4 mol/L(3 ~ 7mg/L) 。 表 1-4 低濃度臭氧在水中的溶解度 /(mg/L)
在一般水處理中,臭氧濃度較低,所以在水中的溶解度并不大。在較低濃度下,臭氧在水中的溶解度基本滿足亨利定律。低濃度臭氧在水中的溶解度見表 1-4 。 二、臭氧的化學性質 1. 臭氧的化學性質極不穩定,在空氣和水中都會慢慢分解成氧氣,其反應式為: 2O3 →3O2 + 285kJ ( 1-2 ) 由于分解時放出大量熱量,故當其含量在 25 %以上時,很容易爆炸。但一般臭氧化空氣中臭氧的含量很難超過 10 %,在臭氧用于飲用水處理的較長歷史過程中,還沒有一例氧爆炸的事例。 含量為 1 %以下的臭氧,在常溫常壓的空氣中分解半衰期為 16h 左右。隨著溫度的升高,分解速度加快,溫度超過 100℃ 時,分解非常劇烈,達到 270℃ 高溫時,可立即轉化為氧氣。臭氧在水中的分解速度比空氣中快的多。在含有雜質的水溶液中臭氧迅速回復到形成它的氧氣。如水中臭氧濃度為 6.25×10 -5 mol/L(3mg/l) 時,其半衰期為 5 ~ 30min ,但在純水中分解速度較慢,如在蒸餾水或自來水中的半衰期大約是 20min ( 20℃ ),然而在二次蒸餾水中,經過 85min 后臭氧分解只有 10 %,若水溫接近 0℃ 時,臭氧會變得更加穩定。
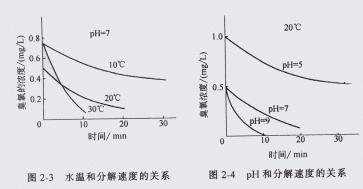
臭氧在水中的分解速度隨水溫和 PH 值的提高而加快,圖 1-3 為 PH=7 時,水溫和分解速度的關系,圖 1-4 為 20℃ , PH 和分解速度的關系。 為提高臭氧利用率,水處理過程中要求臭氧分解得慢一些,而為了減輕臭氧對環境的污染,則要求處理后尾氣中的臭氧分解快一些。 2. 臭氧的氧化能力 臭氧得氧化能力極強,其氧化還原電位僅次于 F 2 ,在其應用中主要用這一特性。從表 1-5 中看出。 從表 1-5 可知,臭氧的標準電極電位除比氟低之外,比氧、氯、二氧化氯及高錳酸鉀等氧化劑都高。說明臭氧是常用氧化劑中氧化能力最強的。同時,臭氧反應后的生成物是氧氣,所以臭氧是高效的無二次污染的氧化劑。 表 1-5 氧化還原電位比較
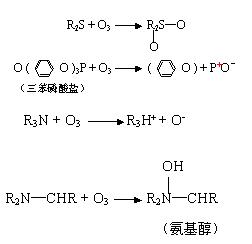
3. 臭氧的氧化反應 a 、與無機物的氧化反應 ⑴ 臭氧與亞鐵的反應
⑵ 臭氧與 Mn2+ 的反應
⑶ 臭氧與硫化物的反應
⑷ 臭氧與硫氰化物的反應
⑸ 臭氧與氰化物的反應
總反應為:
⑹ 臭氧與氯的反應
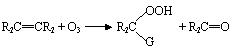
b 、臭氧與有機物的反應 臭氧在水溶液中與有機物的反應極其復雜,下面僅以大家公認的幾種反應式列出以供參考。 ⑴ 臭氧與烯烴類化合物的反應 臭氧容易與具有雙鏈的烯烴化合物發生反應,反應歷程描述如下:
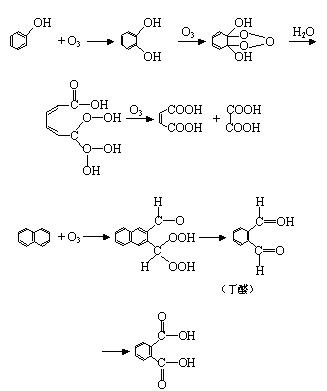
式中 G 代表 OH 、 OCH3 、 OCCH3 等基。反應的最終產物可能是單體的、聚合的、或交錯的臭氧化物的混合體。臭氧化物分解成醛和酸。 ⑵ 臭氧和芳香族化合物的反應 臭氧和芳香族化合物的反應較慢,在系列苯<萘<菲<嵌二萘<蒽中,其反應速度常數逐漸增大。其
⑶ 對核蛋白(氨基酸)系的反應
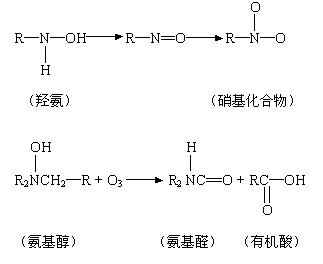
⑷ 對有機氨的氧化
臭氧在下列混合物的氧化順序為 鏈烯烴>胺>酚>多環芳香烴>醇>醛>鏈烷烴 c 、臭氧的毒性和腐蝕性 臭氧屬于有害氣體,濃度為 6.25×10 -6 mol/L(0.3mg/m3 ) 時,對眼、鼻、喉有刺激的感覺;濃度 (6.25-62.5)×10 -5 mol/L(3 ~ 30mg/m3 ) 時,出現頭疼及呼吸器官局部麻痹等癥 ; 臭氧濃度為 3.125×10 -4 ~ 1.25×10 -3 mol/L(15 ~ 60mg/m 3 ) 時 , 則對人體有危害。其毒性還和接觸時間有關,例如長期接觸 1.748×10 -7 mol/L(4ppm) 以下的臭氧會引起永久性心臟障礙,但接觸 20ppm 以下的臭氧不超過 2h ,對人體無永久性危害。因此,臭氧濃度的允許值定為 4.46×10 -9 mol/L(0.1ppm)8h. 由于臭氧的臭味很濃,濃度為 4.46×10 -9 mol/L(0.1ppm) 時,人們就感覺到,因此,世界上使用臭氧已有一百多年的歷史,至今也沒有發現一例因臭氧中毒而導致死亡的報道。 臭氧具有很強的氧化性,除了金和鉑外,臭氧化空氣幾乎對所有的金屬都有腐蝕作用。鋁、鋅、鉛與臭氧接觸會被強烈氧化,但含鉻鐵合金基本上不受臭氧腐蝕。基于這一點,生產上常使用含 25 % Cr 的鉻鐵合金(不銹鋼)來制造臭氧發生設備和加注設備中與臭氧直接接觸的部件。 臭氧對非金屬材料也有了強烈的腐蝕作用,即使在別處使用得相當穩定得聚氯乙烯塑料濾板等,在臭氧加注設備中使用不久便見疏松、開裂和穿孔。在臭氧發生設備和計量設備中,不能用普通橡膠作密封材料,必須采用耐腐蝕能力強的硅橡膠或耐酸橡膠等。
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
版權所有
© 萊特企業 & 廣州奧聯環保科技有限公司
|