|
 |
||||||
|
|
首 頁 | 公司簡介 | 產品展示 | 加盟合作 | 科普園地 | 聯系我們 | 產品購買 |
|
|
水質(糞)大腸菌群快速檢驗紙片
分BD105Ⅰ和BD105Ⅱ兩個型號,請注意選擇型號。 1、適用范圍 水質(糞)大腸菌群的測定紙片快速法 本標準規定了總大腸菌群、糞大腸菌群的快速測定方法。 本標準適用于地表水、生活污水、醫療機構及禽畜養殖業等其他行業排放的廢水中(糞)大腸菌群的快速篩查。 本方法的檢出限為20MPN/L。 2、 2、規范性引用文件 本標準內容引用了下列文件或其中的條款。凡是不注明日期的引用文件,其有效版本適用于本標準。HJ/T91地表水和污水監測技術規范 3、 3、術語和定義 下列術語和定義適用于本標準。 3.1總大腸菌群(total coliforms) 在37℃培養,24h內能發酵乳糖酸產氣的需氧及兼性厭氧的革蘭氏陰性無芽胞桿菌。
3.2 糞大腸菌群(fecal coliforms) 44.5℃培養,24h內能發酵乳糖產酸氣的總大腸菌群,屬糞行來源,稱為糞大腸菌群。 4、方法原理 將一定量的乳糖、指示劑(溴甲酚紫和2,3, 5-氯化三苯基四氮唑即TTC)以及營養成分等吸附于一定面積的無菌濾紙上,當細菌生長繁殖時,產酸使PH值降低,溴甲酚紫指示劑由紫色變黃色。同時,產氣過程相應的脫氫酶在適宜的PH范圍內,催化底物脫氫還原TTC形成紅色的不溶性三苯甲臜(TTF),即可在產酸后的黃色背景下顯示出紅色斑點(或紅暈)。通過上述指示劑的顏色變化就可對是否產酸產氣作出判斷,從而確定是否有(糞)大腸菌群存在,再通過查MPN表就可得出相應(糞)大腸菌群的濃度值。 5、試劑和材料 除非另有說明,分析時均使用符合國家標準的分析純化學試劑。 5.1市售水質總大腸菌群、糞大腸菌群測試片:10ml水樣量紙片按附錄A的方法進行質量鑒定,達到要求后方可使用。 5.2無菌水 用新制備的去離子水或蒸餾水,按無菌操作要求,121℃高壓蒸汽滅菌20min,備用。 5.3硫代硫酸鈉溶液:ρ(Na2S2O3)=0.10g/ml 稱取硫代硫酸鈉10g,溶于適量蒸餾水(或去離子)中,稀釋至100ml,現配。 5.4乙二胺四乙酸二鈉(EDTA- Na2)溶液:ρ(C10H14N2O8Na2。 2H2O)=0.15g/ml 稱取EDTA-Na2 15g,溶于適量蒸餾水(或去離子水)中,稀釋至100ml,此溶液保質期為30d。 6 6、 儀器和設備 6.1 恒溫培養箱:37℃±1℃。 6.2 恒溫培養箱:44℃±0.5℃。 6.3 高壓蒸汽滅菌器:121℃、101.3kpa。 6.4 冰箱:0-4℃ 6.5 移液管:1±0.01ml、10±0.1ml。 6.6 試管:φ15mm×150mm. 6.7 采樣瓶:500ml。 注1:移液器、試管、采樣瓶等玻璃器皿實驗前要按無菌操作要求包扎,121℃高壓蒸汽滅菌20min,烘干,備用。
6 7、樣品 用滅菌器具,按照HJ/T 91的規定及無菌操作的要求,采集水樣400ml放入已滅菌的采樣瓶中。如果是經加氯處理的廢水,需在采樣瓶滅菌前加入乙二胺四乙酸二鈉(EDTA- Na2)溶液(5.4)1.2ml,以消除干擾。酸性樣品,需調節胖胖的PH值至7.0-8.0。 采樣后2h內檢測,否則,需10℃以下冷藏并6h內送檢,實驗室接樣后,應將樣品放入0-4℃冰箱并2h內測定。 注2:10mg硫代硫酸鈉可保證去除水樣中1.5mg余氯,硫代硫酸鈉用量克根據水樣實際余氯量調整。
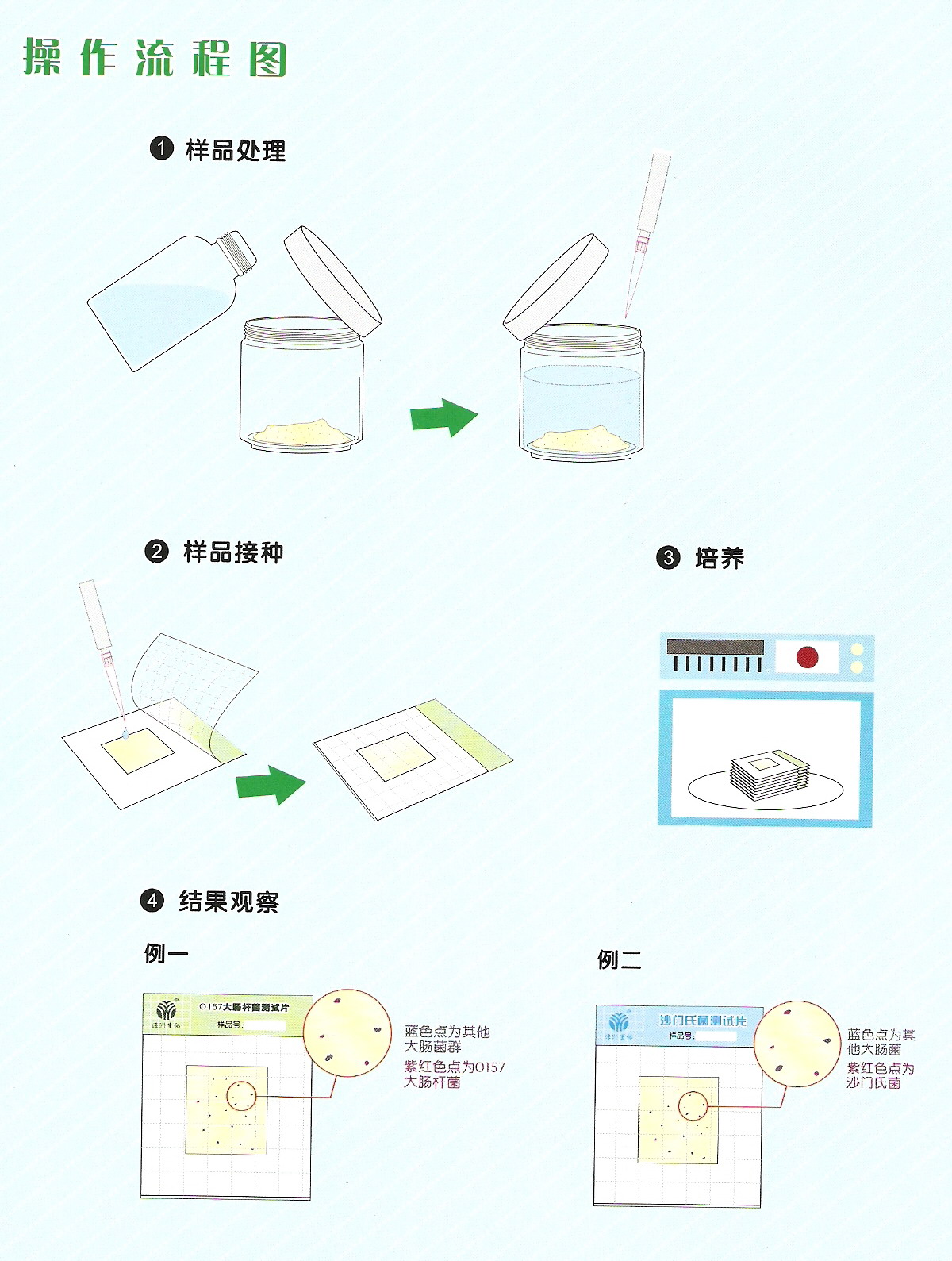
7 8、分析步驟 8.1接種量 每個樣品按三個不同的接種量接種,每個接種量分別接種5張紙片,共接種15張紙片。 根據水樣的污染程度確定接種量,應盡可能使5個接種量最大的紙片為陽性、5個接種量最小的紙片為陰性。 清潔水樣的參考接種量分別為10 ml、1 ml、0.1 ml,受污染水樣參考接種量根據污染程度可接種1 ml、0.1ml、0.01 ml或0.1 ml、0.01 ml、0.001 ml等,見下表1。 表1水樣接種量參考表 接種量小于1ml時,水樣應制成稀釋樣品后使用。接種量為0.1ml、0.01 ml時,分別制成1:10稀釋樣品、1:100稀釋樣品。其它接種量的稀釋樣品依次類推。 1:10稀釋樣品的制作方法為:吸取1ml水樣,注入盛有9 ml無菌水的試管中,混勻,制成1:10稀釋樣品。其它稀釋度的稀釋樣品同法制作。
8.2接種、培養 水樣充分混勻,按無菌操作制作稀釋水樣及接種水樣。 清潔水樣,接種水樣總量為55.5ml,10 ml水樣量紙片5張,每張接種水樣10ml,1 ml水樣量紙片10張,其中5張各接種水樣1ml,另5張各接種1:10的稀釋水樣1ml。受污染水樣,接種3個不同稀釋度的1ml稀釋水樣各5張。 接種水樣應均勻涂布于紙片上,紙片充分侵潤、吸收水樣,用手輕輕壓平,做好標記。 測總大腸菌群時,在37±1℃的條件下培養18-24h后觀察結果;測糞大腸菌群時,在44.5±0.5℃的條件下培養18-24h后觀察結果。 注3:1、檢測糞大腸菌群時,紙片接種后應立即放置于44.5±0.5℃的恒溫培養箱中培養,在常溫下放置過久將影響檢測結果的準確性。 2、紙片加入水樣后,短時間內變黃或退色,表明水樣存在酸性物質活氧化劑干擾,需按“7樣品”一節方法去除相應干擾。
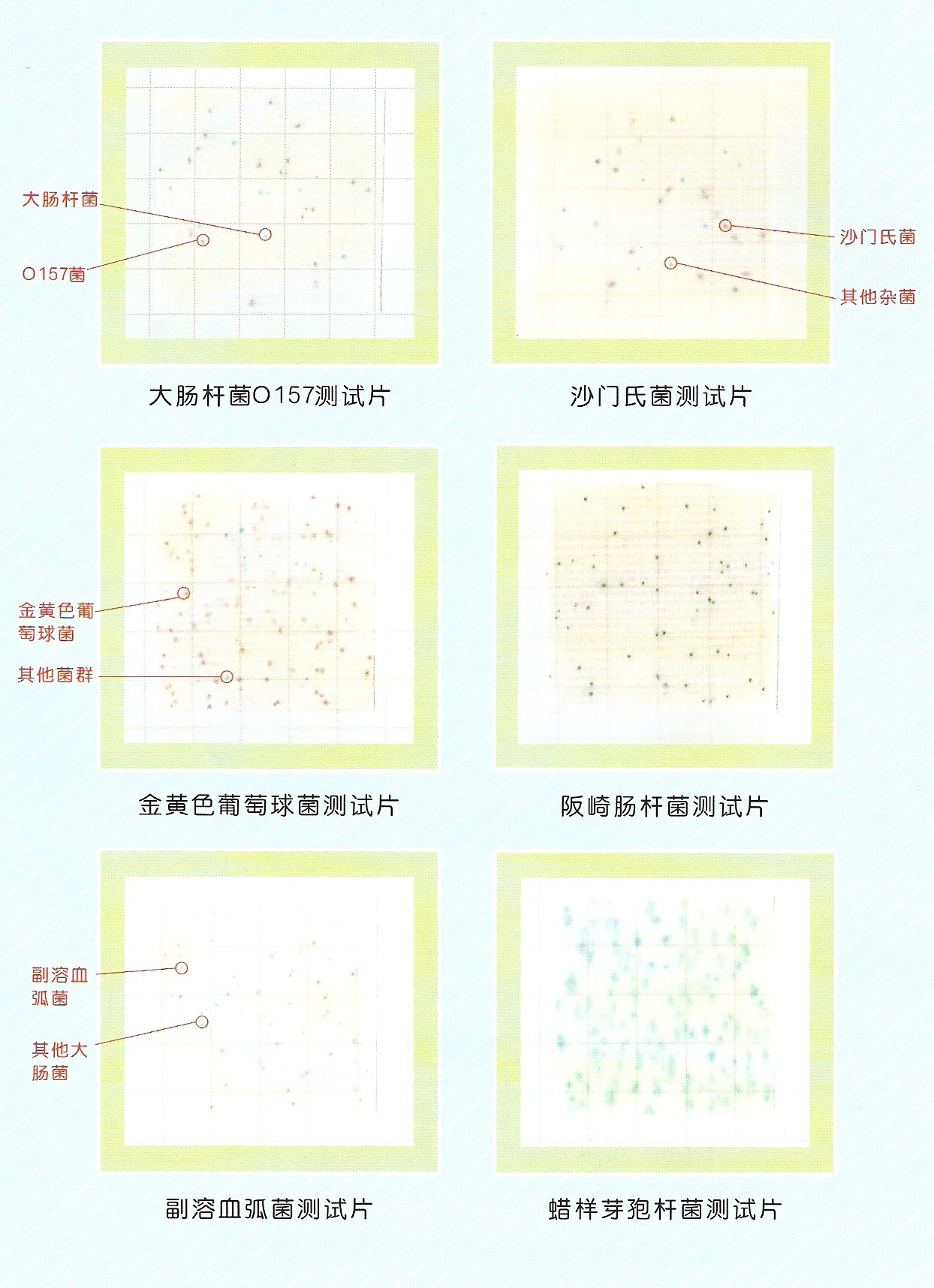
8.3結果判定 (1)紙片上出現紅斑或紅暈且周圍變黃,為陽性。 (2)紙片全片變黃,無紅斑或紅暈,為陽性。 (3)紙片部分變黃,無紅斑或紅暈,為陰性。 (4)紙片的紫色背景上出現紅斑或紅暈,而周圍不變黃,為陰性。 (5)紙片無變化,為陰性。 結果判斷參照圖片見附錄B。 6 9、結果計算與表示 6.1 9.1結果計算 根據不同接種量的陽性紙片數量,查MPN表(附錄C),經下面的公司換算報告1L水中(糞)大腸菌群數: 6.2 9.2結果表示 測定結果保留二位有效數字,大于100時以科學計數法表示,結果的單位為MPN/L。平均值以幾何平均計算。 7 10、 精密度和準確度 微生物檢測書記為偏態分布,按其統計分析要求,其檢測所得MPN值全部經對數(以10為底)轉換后進行以下分析。 10.1精密度 6家實驗室分別對有證標準樣品(15600MPN/L)、低濃度(4.0×102 MPN/L)、中濃度(1.0×104 MPN/L)、高濃度(8.0×104MPN/L)實際樣品的總大腸菌群進行了測定,實驗室內相對標準偏差范圍分別為:4.5%~7.5%、3.5%~12.4%、4.5%~6.9%、2.8%~5.8%;實驗室間的相對標準偏差范圍分別為:3.3%、12.6%、4.6%、1.6%;重復限為0.61、0.67、0.67、0.64;再現性限為1.09、0.81、0.66、0.69。 6家實驗室分別對有證標準樣品(12100MPN/L)、低濃度(1.0×102 MPN/L)、中濃度(4.0×103 MPN/L)、高濃度(5.0×104 MPN/L)實際樣品的糞大腸菌群進行了測定,實驗室內的相對標準偏差范圍分別為:4.5%~11.3%、11.4%~31.3%、2.8%~21.5%、3.9%~13.2%;實驗室間的相對標準偏差分別為5.2%、14.8%、11.9%、8.2%。重復性限為0.93、0.83、0.85、0.77;再現性限為1.28、1.44、1.35、0.89。 10.2 10.2準確性 6家實驗室對總大腸菌群有證標準樣品(15600MPN/L)進行測定,實驗室內相對誤差的范圍是-5.5%~-12.8%,相當誤差的最終值為-8.8%±6.0%。 6家實驗室對糞大腸菌群有證標準樣品(12100MPN/L)進行測定,實驗室內相對誤差的范圍是-3.8%~-16.0%,相對誤差的最終值為-10.3%±9.2%。 11 11、 質量保證和質量控制 11.1應使用質量鑒定合格的紙片。 11.2每批樣品應用無菌水做全程序空白測定,培養后的紙片上不的有任何微生物生長,否則,該次樣品測定結果無效,應查明原因后重新測定。 11.3每批樣品應使用有證標準菌株進行陽性、陰性對照試驗。總大腸菌群測定的陽性菌株為大腸埃希氏菌,陰性菌株為金黃色葡萄菌;糞大腸菌群測定的陽性菌株為大腸埃希氏菌,陰性菌株為產氣腸桿菌。 上述標準菌株均制成濃度為300~3000個/ml的菌懸液,分別取相應水量的菌懸液接種紙片,按“8.2接種、培養”一節的要求培養,大腸埃希氏菌應呈現陽性反應;金黃色葡萄球菌、產氣腸桿菌應呈現陰性反應,否則,該次樣品測定結果無效,應查明原因后重新測定。 12 12、廢棄處理 使用后的器皿及廢棄物須用121℃高壓蒸汽滅菌20min后,器皿方可清洗,廢棄物作為普通垃圾處理。
微生物 快速檢測產品展示
|
|
版權所有
© 萊特企業 & 廣州奧聯環保科技有限公司
|